病毒载体生产过程中,可以通过评估HCD的残留来对非特异性核酸酶的使用进行优化,主要包括以下步骤:
1)分析检测未处理的过程中间品中HCD残留量和HCD片段大小分布;
2)根据非特异性核酸酶的酶活计算所需酶量;Benzonase可参照以下公式:
X(u/ml)=DNA浓度(ug/ml)/37
3)设定梯度酶浓度(如0.5×,1×,2×,3×等),作用时间(如1、2、4、8、12、24小时等),作用温度(20,25,37℃)及测试规模;
4)收集不同工艺点核酸酶处理后的样品,检测HCD残留和HCD片段大小分布。
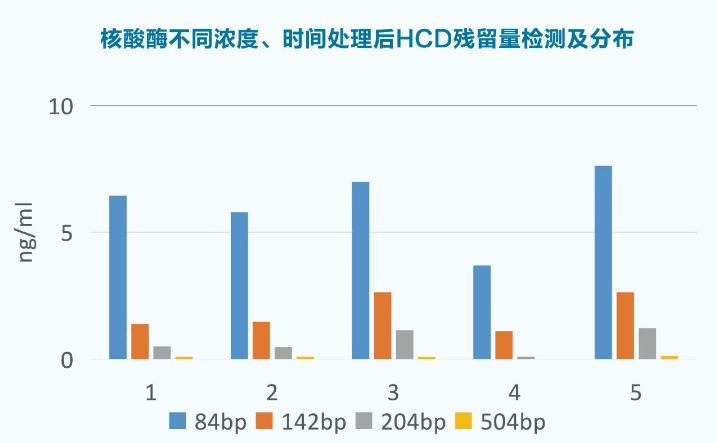
图1 不同酶量、不同孵育时间核酸酶处理后,HCD残留量和HCD大小分布情况
基因治疗用病毒载体实际生产过程中,需要规模化的GMP级质粒用于转染步骤,过程还涉及质粒制备(图2)。因此,除了工艺引入的非特异性核酸酶中存在的宿主DNA残留外,还需严格控制质粒E.coli宿主细胞残留DNA、RNA和残留蛋白。
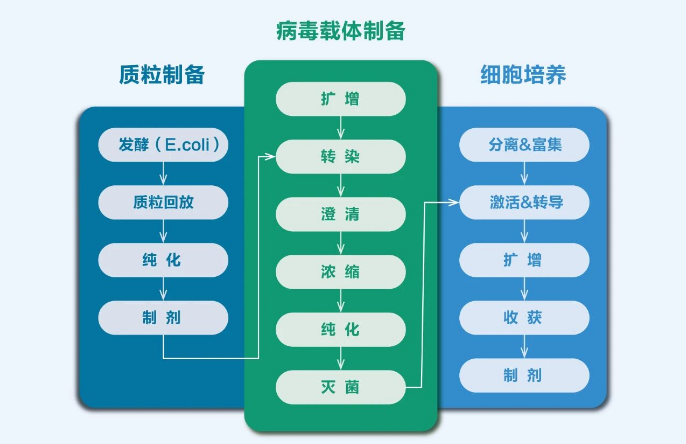
图2 基因治疗用病毒载体生产流程[2]
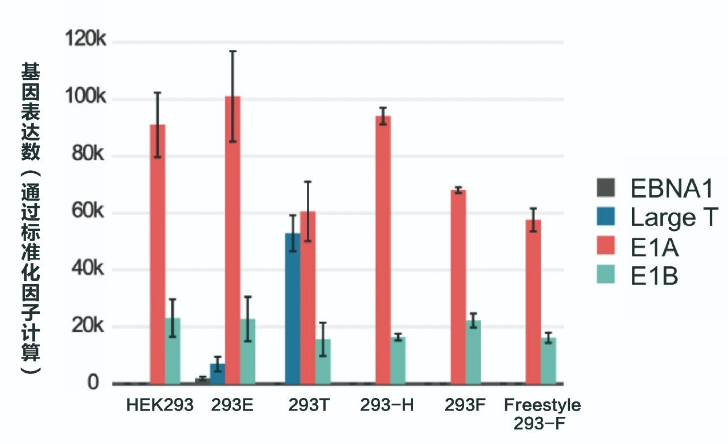
需要特别注意的是,FDA提醒使用HEK293T细胞生产病毒载体时因存在SV40 T抗原,还需要检测残留的腺病毒E1(E1A & E1B)和SV40 T抗原序列。《中国药典》有关生物制品宿主残留核酸质量控制要求和CDE颁布的《细胞治疗产品申请临床试验药学研究和申报资料的考虑要点》中关于质粒和病毒载体的质量标准也提到,如使用HEK293细胞进行病毒载体生产,需进行宿主DNA和RNA残留、SV40大T抗原DNA残留、E1A和E1B基因DNA残留检测。
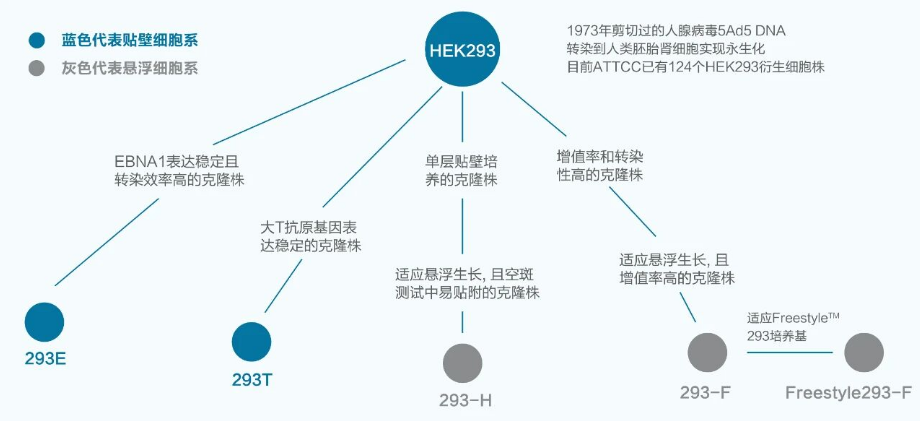
图3 六种 HEK293 细胞系的谱系关系示意图[1]
划重点:
►非特异性核酸酶广泛应用于病毒载体生产中的核酸残留消解;
►对病毒载体生产过程中相关DNA需要全面检测分析,包括病毒载体包装生产所用的细胞系HCD,特定细胞系所携带的风险基因,以及HCD的片段分布;
►高品质全面的HCD及风险基因DNA检测试剂盒使得核酸酶处理工艺的优化保证了稳定的残留核酸清除和高质量的病毒载体。
湖州申科基于基因治疗用病毒载体生产相关质控风险,研发了一系列具有自主知识产权的宿主细胞DNA残留量及片段分析检测试剂盒、HEK293细胞系HCD和相关风险基因检测试剂盒,以及非特异性核酸酶残留检测试剂盒等,能够快速检测基因治疗产品研发和生产过程的中间品、半成品和成品中核酸和由此引入的工艺杂质残留。
HEK293细胞系残留DNA检测及风险基因检测
| 货号 | 产品名称 |
| 1101104 | HEK293残留DNA检测试剂盒 |
| 1201202 | 293T总RNA残留检测试剂盒 |
| SK030213SV100 | SV40LTA & E1A残留DNA检测试剂盒 |
| 1101109 | E1A残留DNA检测试剂盒 |
| 1101110 | E1B残留DNA检测试剂盒 |
宿主细胞残留DNA/RNA检测
| 货号 | 产品名称 |
| SK030207H100 | Human 残留 DNA 检测试剂盒 |
| SK030202E100 | E.coli 残留 DNA 检测试剂盒 |
| 1201201 | E.coli 总RNA残留检测试剂盒 |
| SK030217PL100 | 质粒 DNA残留检测试剂盒 |
| SK030204V100 | Vero 残留 DNA 检测试剂盒 |
宿主细胞残留DNA片段分析检测
| 货号 | 产品名称 |
| 1103171-2 | E.coli残留DNA片段分析检测试剂盒(2G) |
| 1103170-2 | CHO残留DNA片段分析检测试剂盒(2G) |
| 1103173 | Human残留DNA片段分析检测试剂盒(2G) |
| 1103174 | Vero残留DNA片段分析检测试剂盒(2G) |
| 1103175 | MDCK残留DNA片段分析检测试剂盒 |
湖州申科作为生物制药质量分析专用试剂的国内主要供应商,核心产品在FDA备案了DMF,多项发明专利应用于药品法规的技术通则,成功支持多家客户进行中、美、欧的IND及BLA申报。
参考文献:
[1] Magdalena Malm.Evolution from adherent to suspension:systems biology of HEK293 cell line development [J].Scientifc Reports,(2020) 10:18996
[2] Jane F. Barlow.Insights on Successful Gene Therapy Manufacturing and Commercialization[EB/OL].https://go.pall.com/genetherapyebook.html,2021-1-12
